借助中頻電流將藥物導入人體的中頻藥物導入治療儀���,在我國屬于第二類醫(yī)療器械注冊產(chǎn)品,根據(jù)《醫(yī)療器械分類目錄》(2017 年第 104 號公告)�����,其分類編碼是09-08-06�����,本文為大家介紹中頻藥物導入治療儀產(chǎn)品工作原理及醫(yī)療器械注冊要點����,一起看正文。
借助中頻電流將藥物導入人體的中頻藥物導入治療儀�,在我國屬于第二類醫(yī)療器械注冊產(chǎn)品,根據(jù)《醫(yī)療器械分類目錄》(2017 年第 104 號公告)�����,其分類編碼是09-08-06,本文為大家介紹中頻藥物導入治療儀產(chǎn)品工作原理及醫(yī)療器械注冊要點���,一起看正文�。
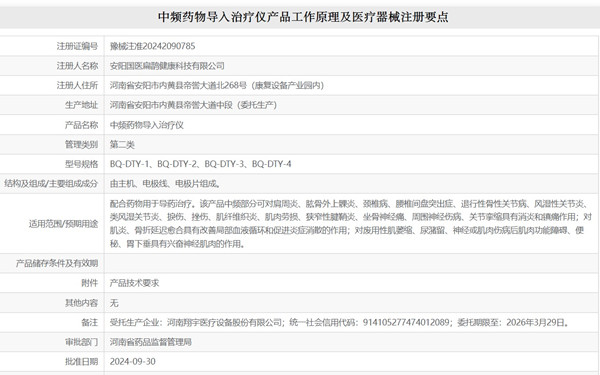
一���、中頻藥物導入治療儀產(chǎn)品工作原理
中頻電流藥物導入:中頻電流可以提高活性生物膜的通透性���。此法兼具中頻電療和藥物的綜合作用。中頻電療法是應用
頻率為 1kHz—100kHz 的交流電(包括正弦波���、脈沖波和調(diào)制波等)進行治療��、康復的方法����。主要治療作用:(1)鎮(zhèn)痛(2)促進局部血液循環(huán)(3)促進淋巴回流(4)興奮神經(jīng)肌肉(5)提高平滑肌張力作用(6)調(diào)節(jié)自主神經(jīng)功能(7)消炎(8)藥物離子導入���。
二��、中頻藥物導入治療儀產(chǎn)品注冊要點
2.1軟件研究
藥物導入設備如含有軟件組件����,應關注是否已按照《醫(yī)療
器械軟件注冊審查指導原則(2022 年修訂版)》(2022 年第 9 號
通告)的要求提交軟件相關研究資料。如適用�����,還應關注是否
已按照《醫(yī)療器械網(wǎng)絡安全注冊審查指導原則(2022 年修訂版)》
(2022 年第 7 號通告)的要求提交網(wǎng)絡安全相關研究資料�。
2.2生物學特性研究
依據(jù) GB/T 16886.1 標準中的方法���,對藥物導入設備中與患者直接或間接接觸的部分進行生物相容性評價�����,一般包括電極
(如適用)���、超聲治療頭或超聲治療固定貼(如適用)、綁帶(如
適用)等��。
生物相容性評價研究資料應關注:
(1)生物相容性評價的依據(jù)和方法�。
(2)產(chǎn)品所用材料的描述及與人體接觸的性質(zhì)。
(3)實施或豁免生物學試驗的理由和論證����,如該部件/附件
為已注冊或備案的醫(yī)療器械產(chǎn)品。
(4)對于現(xiàn)有數(shù)據(jù)或試驗結果的評價。
依據(jù) GB/T 16886.1-2022 附錄 A《生物學風險評定涉及的終
點》中表 A1 要考慮的評價試驗�,至少需要做的生物相容性評價試驗為細胞毒性、致敏反應��、刺激或皮內(nèi)反應(經(jīng)粘膜導入適
用)�����。
可根據(jù)《關于印發(fā)醫(yī)療器械生物學評價和審查指南的通知》
(國食藥監(jiān)械〔2007〕345 號)進行生物學評價�。
生物學評價主要對以下內(nèi)容進行評價:
——醫(yī)療器械材料的定性與定量的說明或分析。
——醫(yī)療器械/材料與市售產(chǎn)品的等同性比較:比較材料和
產(chǎn)品的用途是否等同����;比較兩者的生產(chǎn)過程(加工過程、滅菌
過程��、包裝等)是否相同�����。
生物性能試驗要求應關注以下內(nèi)容:
——細胞毒性試驗:按照 GB/T 16886.5 中規(guī)定的方法進行
檢驗���,應≤2 級(定性評價)或無潛在毒性影響(定量評價)���。
——刺激或皮內(nèi)反應:按照 GB/T 16886.10 中規(guī)定的方法進
行檢驗���,極性浸提和非極性浸提下應無刺激或皮內(nèi)反應。
——遲發(fā)型超敏反應試驗:按照 GB/T 16886.10 中規(guī)定的方
法進行檢驗�,極性浸提和非極性浸提下應無遲發(fā)型超敏反應。
材料名稱相同并不代表材料相同��,除非來自同一供應商(即材料的生產(chǎn)商��,而非經(jīng)銷商或代理商)���。不同的供應商材料的配
方可能存在差異。
三���、中頻藥物導入治療儀產(chǎn)品技術要求
醫(yī)療器械注冊申請人可以根據(jù)自身產(chǎn)品的特點制定相應的技術要求��,
但性能指標不得低于相關國家標準���、行業(yè)標準的有關要求。如有不適用條款�,應在研究資料的性能研究中說明理由。
3.1 應關注產(chǎn)品規(guī)格相關信息�����,可以附錄的形式提供,至少包含以下信息:
(1)藥物導入設備型號/規(guī)格及其劃分說明�。
(2)對同一注冊單元中存在多種型號和/規(guī)格的產(chǎn)品,應明確各型號及各規(guī)格之間的所有區(qū)別(推薦采用圖示和/或表格的
方式)����。
(3)對包含軟件的產(chǎn)品,應明確軟件發(fā)布版本和軟件完整
版本命名規(guī)則��。
3.2 性能要求
通常應包括物理性能指標��,如電刺激性能指標和(或)超
聲性能指標�,具體根據(jù)設備的技術特點而定。
(1)中頻藥物導入設備���,根據(jù)《中頻電療產(chǎn)品注冊技術審
查指導原則》(2017 年修訂版)�,中頻電療產(chǎn)品應至少包括以下
技術指標的要求:
1)工作頻率為 1kHz—100kHz 范圍內(nèi)的單一頻率或頻段�����,
頻率允差±10%�����。
2)輸出電流:在 500Ω的負載電阻下���,輸出電流必須不超
過以下的限值:頻率≤1500Hz�����,為 80mA(r.m.s)�����;頻率>1500Hz
為 100mA(r.m.s)���。
3)輸出電流穩(wěn)定度:不同負載下的輸出電流變化率應不大
于 10%����。
4)調(diào)制頻率范圍:低頻調(diào)制中頻電療設備調(diào)制頻率應在 0-150Hz 范圍內(nèi)�。
5)差頻頻率范圍:干擾電治療設備差頻頻率應在 0—200Hz
范圍內(nèi)�����。(如適用)
6)調(diào)幅度:低頻調(diào)制中頻電療設備輸出波形應有調(diào)幅度指
標����,或連續(xù)在 0%—100%的調(diào)幅度范圍內(nèi)可調(diào),調(diào)幅度允差±5%�。
7)動態(tài)節(jié)律:動態(tài)干擾電治療設備的動態(tài)節(jié)律為 4s—10s�。
(如適用)
8)差頻變化周期:干擾電治療設備的差頻變化周期為 15s -30s��。(如適用)
9)連續(xù)工作時間應不少于 4h�����。
10)設備載波及調(diào)制波的頻率和波形應加以描述�����。
11)處方的類型及載波波形應加以描述����。
3.3 安全要求
(1)電氣安全應符合 GB 9706.1、GB 9706.205(如適用)����、
YY 9706.210(如適用)的要求。
(2)電磁兼容應符合 YY 9706.102��、GB 9706.205(如適用)����、
YY 9706.210(如適用)的要求。
如有中頻藥物導入治療儀或是其他醫(yī)療器械注冊咨詢服務需求�����,歡迎您隨時方便與杭州證標客醫(yī)藥技術咨詢有限公司聯(lián)絡,聯(lián)系人:葉工����,電話:18058734169,微信同�。